Quimica
ENTALPIA
¿Qué es la entalpía?
Cuando se habla de entalpía, se hace alusión específicamente a la cantidad de energía que un sistema termodinámico intercambia con su medio ambiente, es decir, la cantidad de energía que el sistema absorbe o libera a su entorno. En física y química, se suele representar esta magnitud con la letra H y se la mide en julios (J).
Teniendo en cuenta que todo objeto conocido puede comprenderse como un sistema termodinámico, la entalpía hace referencia a la cantidad de calor que se pone en juego en condiciones de presión constante, dependiendo de si el sistema recibe o más bien aporta energía.
De acuerdo a esto, todo proceso o transformación puede clasificarse en dos tipos:
- Endotérmicos. Aquellos que consumen calor o energía del medio ambiente.
- Exotérmicos. Aquellos que liberan calor o energía hacia el medio ambiente.
 Dependiendo del tipo de materia que intervenga en el sistema (por ejemplo, sustancias químicas en una reacción), dependerá el grado de entalpía del mismo.
Dependiendo del tipo de materia que intervenga en el sistema (por ejemplo, sustancias químicas en una reacción), dependerá el grado de entalpía del mismo.
La primera vez que se empleó este término en dicho sentido lo hizo el físico holandés Heike Kamerlingh Onnes, descubridor de la superconductividad y ganador del Premio Nobel de Física en 1913. Otro nombre para lo mismo es contenido de calor.
Ver también: Reacciones Endotérmicas.
Tipos de entalpía
Los tipos de entalpía dependen de los procesos de transformación que implique el sistema, y pueden ser:
- Entalpía de formación. La cantidad de energía que se absorbe o se libera cuando un mol de sustancias reaccionan para formar una sustancia compuesta.
- Entalpía de descomposición. A la inversa, es la cantidad de energía absorbida o liberada cuando una sustancia compleja deviene en sustancias más simples.
- Entalpía de combustión. Es la energía liberada o absorbida por la quema de 1 mol de sustancia, siempre en presencia de oxígeno gaseoso.
- Entalpía de neutralización. Implica la energía liberada o absorbida siempre que una solución ácida y una básica se mezclen, es decir, cuando bases y ácidos se neutralicen recíprocamente.
Estos tipos de entalpía son de suma importancia para la química, ya que entienden reacciones como sistemas termodinámicos. Por ello se les conoce como entalpía química. Por otro lado, podemos hablar de sus equivalentes físicos, que son:
- Entalpía de cambio de fase. Aquella que implica la absorción o liberación de energía cuando una sustancia pasa de un estado de agregación a otro, es decir, de gas a sólido o a líquido, etc. Se subdivide en: entalpía de vaporización, entalpía de solidificación y entalpía de fusión, principalmente.
- Entalpía de disolución. Aquella propia de la mezcla de un soluto y un solvente, comprensible en dos fases: reticular (absorbe energía) y de hidratación (libera energía).
LEY DE HESS
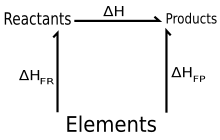
En termodinámica, la ley de Hess, propuesta por Germain Henri Hess en 1840, establece que: «si una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas», esto es, que los cambios de entalpía son aditivos: ΔHneta = ΣΔHr.
Equivalentemente, se puede decir que el calor de reacción solo depende de los reactivos y los productos, o que el calor de reacción es una función de estado; en este sentido la ley de Hess es la aplicación a las reacciones químicas del primer principio de la termodinámica; debido a que fue enunciada unos diez años antes que ésta, conserva su nombre histórico.El propósito de este planteamiento es analizar de forma muy breve las bases de la Termoquímica como una solución a problemas de transferencia de calor en dichos procesos.
Cuando se busca saber qué tanto calor como una forma de la energía absorbida o desprendida está presente en una reacción, es porque la misma juega un papel muy importante de los cambios químicos, la pregunta obvia en este caso resulta; ¿a qué se debe esa importancia? Se debe a que en todo cambio químico hay ruptura y formación de nuevos enlaces químicos y para que haya esa ruptura, se requiere energía y algunas veces en la formación de los nuevos enlaces se requiere de menor energía para su formación y por tanto se desprende la energía sobrante, razón por la cual, el estudio del calor y de su relación con los cambios químicos resulta tan importante. Además de lo anterior es necesario también conocer si el proceso depende no solo de si el cambio se efectúa a volumen o presión constante, sino también de las cantidades de sustancia considerada, su estado físico, temperatura y presión.
En virtud de que la cantidad de calor obtenida en una reacción depende de la cantidad de sustancia que intervino en ella, si escribimos que dos gramos de hidrógeno se queman en oxígeno para producir agua líquida, y se desprenden 68,320 calorías, entonces cuando incrementamos a cuatro gramos, el calor desprendido es doble y así sucesivamente. Esto es, que en vez de especificar la cantidad producido por gramo de sustancia para una reacción particular, es usual hacerlo de la siguiente manera:
- H2 + 1/2 O2 D H2O ∆H = - 68,320 cal
Por ejemplo, el carbono en forma de grafito puede oxidarse hasta dióxido (1) o monóxido (2) de carbono, por otro lado, el monóxido de carbono puede oxidarse hasta dióxido (3). Como se ve a continuación, la suma de las entalpías de la reacción en dos pasos (2)+(3) es igual a la entalpía de la reacción en un paso (1):
ENERGÍA DE ACTIVACIÓN
En química, la energía de activación es la energía mínima que necesita un sistema antes de poder iniciar un determinado proceso. A presión constante, la energía de activación viene determinada por la siguiente ecuación:1donde:
- es la constante de los gases ideales
- es la temperatura
- es la constante de reacción
La energía de activación suele utilizarse para denominar la energía mínima necesaria para que se produzca una reacción química dada. Para que ocurra una reacción entre dos moléculas, éstas deben colisionar en la orientación correcta y poseer una cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes de electrones se repelen. Para superar esto se requiere energía (energía de activación), que proviene de la energía térmica del sistema, es decir la suma de la energía traslacional, vibracional, y rotacional de cada molécula. Si la energía es suficiente, se vence la repulsión y las moléculas se aproximan lo suficiente para que se produzca una reordenación de sus enlaces. La ecuación de Arrhenius proporciona una expresión cuantitativa para la relación entre la energía de activación y la velocidad a la que se produce la reacción. Arrhenius introdujo el término energía de activación en 1889. El estudio de las velocidades de reacción se denomina cinética química.Un ejemplo particular es el que se da en la combustión de una sustancia. Por sí solos el combustible y el comburente no producen fuego, es necesario un primer aporte de energía para iniciar la combustión, que luego es autosostenida. El aporte de una pequeña cantidad de calor puede bastar para que se desencadene una combustión, haciendo la energía calórica aportada el papel de energía de activación, y por eso a veces a la energía de activación se la llama entalpía de activación.Según su origen, este primer aporte de energía se clasifica como:

- químico: La energía química exotérmica desprende calor, que puede ser empleado como fuente de ignición.
- eléctrico: El paso de una corriente eléctrica o un chispazo produce calor.
- nuclear: La fusión y la fisión nucleares producen calor.
- mecánico: Por compresión o fricción, la fuerza mecánica de dos cuerpos puede producir calor.
Las siguientes representaciones gráficas manifiestan diferencias acerca de cómo la presencia de un catalizador (ejemplo una enzima en un proceso biológico) disminuye la energía de activación debido a su complementariedad y por tanto provoca una disminución en el tiempo requerido para que se forme el producto, o sea, aumenta la velocidad.






me ayudo mucho con mi tarea, muy bien explicado
ResponderBorrarQue buen trabajo, me gusto mucho tu información
ResponderBorrar